登革熱(Dengue fever�,DF)是由登革病毒(Dengue virus,DENV)引起���,經(jīng)媒介伊蚊叮咬傳播的急性傳染病�����。DF在全球存在媒介伊蚊分布的熱帶�、亞熱帶地區(qū)廣泛流行�����,累及全球100多個國家和地區(qū)����,拉丁美洲地區(qū)、西太平洋區(qū)��、東南亞區(qū)��、東地中海區(qū)等地區(qū)DF傳播可常年發(fā)生�。今年全球DF疑似及確診病例上升至253萬多例,總死亡人數(shù)超1000例����,其中巴西疑似及確診病例已上升至105萬例。
中國雖尚未形成穩(wěn)定的DF本地傳播疫源地�,但輸入性病例常年可見,廣東�、云南、福建�、浙江、廣西��、海南等多個省份曾多次發(fā)生輸入引發(fā)的本地傳播DF疫情��,DF流行與氣溫�����、降水兩大因素極為相關(guān),夏秋季高發(fā)�����。各年齡段人群均可發(fā)病���,以青壯年為主���。
全球登革熱檢測:https://worldhealthorg.shinyapps.io/dengue_global/
 圖1. 登革熱的全球分布
圖1. 登革熱的全球分布
(J Water Health. 2023 Nov;21(11):1632-1650. doi: 10.2166/wh.2023.114.)
DENV結(jié)構(gòu)
DENV屬黃病毒科黃病毒屬,病毒顆粒呈球形�,直徑45~55nm,共有4個血清型(DENV-1��、DENV-2��、DENV-3和DENV-4)��,均可導(dǎo)致人類感染����,引發(fā)重癥,其中DENV-4型病毒傳播力較弱����,累及范圍較小���。

圖2. DENV的基因組結(jié)構(gòu)
(J Infect Public Health. 2023 Oct;16(10):1625-1642. doi: 10.1016/j.jiph.2023.08.001)
DENV蛋白功能
其基因組為單股正鏈RNA����,編碼三種結(jié)構(gòu)蛋白,即衣殼(C)�����、前膜(prM)�、包膜(E)和7種非結(jié)構(gòu)蛋白(NS1��、NS2A��、NS2B�、NS3�����、NS4A�����、NS4B和NS5)�,NS1抗原是非結(jié)構(gòu)蛋白中的一種糖蛋白,在急性期血清中大量存在,可作為早期診斷指標(biāo)����。
表1. DENV 蛋白的功能
Pr肽起著保護E上融合肽的帽的作用,從而防止過早融合
通過實現(xiàn)病毒膜和內(nèi)體膜的融合參與病毒的脫殼
RNA解旋酶和RTPase/NTPase-病毒RNA復(fù)制
阻斷IFN-α/β誘導(dǎo)的信號轉(zhuǎn)導(dǎo)��,并幫助病毒逃避宿主的先天免疫反應(yīng)
甲基轉(zhuǎn)移酶結(jié)構(gòu)域
DF發(fā)病機制
DENV經(jīng)伊蚊叮咬侵入人體后���,在單核-巨噬細胞系統(tǒng)增殖后進入血液循環(huán)���,形成第一次病毒血癥,然后定位于網(wǎng)狀內(nèi)皮系統(tǒng)和淋巴組織中����,在外周血單核細胞、組織中的巨噬細胞和肝臟的Kupffer細胞內(nèi)復(fù)制�,再次進入血液循環(huán),形成第二次病毒血癥���,引起臨床癥狀�����。DENV與機體產(chǎn)生的特異性抗體結(jié)合形成免疫復(fù)合物����,激活補體系統(tǒng),導(dǎo)致血管擴張���、充血,通透性增加���,血漿蛋白及血液有形成分外滲�����,引起血液濃縮����、出血和休克等病理生理改變�。同時病毒可抑制骨髓中白細胞和血小板生成。出血機制可能與血小板減少及其功能障礙���、凝血因子消耗有關(guān)�����。
重癥DF發(fā)病機制至今尚未完全闡明����,DENV二次感染所致的抗體依賴性增強作用(Antibody-Dependent Enhancement,ADE)�����、細胞因子風(fēng)暴�、病毒毒力變異等因素發(fā)揮著重要作用。

圖3. DENV侵入過程示意圖
(J Immunol Res. 2016 Jul 20;2016:6803098. doi: 10.1155/2016/6803098)
DENV預(yù)防措施
控制傳播媒介��、防止蚊蟲叮咬是防治登革病毒感染的重要措施�����。其次�,接種登革熱疫苗也能預(yù)防DENV感染,但目前尚無安全�����、有效的登革病毒疫苗�����。
DENV四種血清型(DENV-1-4)的復(fù)雜性以及抗體依賴性增強在重癥登革熱中的潛在作用都阻礙了DENV疫苗的開發(fā)��。由于DENV的獨特特性以及需要針對所有四種血清型提供保護,登革熱疫苗的開發(fā)一直是一個復(fù)雜且具有挑戰(zhàn)性的過程����。在登革熱疫苗開發(fā)的早期階段,使用了完整的滅活或減毒活病毒�。然而,這些早期候選藥物在安全性����、免疫原性以及針對四種血清型中每一種引發(fā)均衡免疫反應(yīng)的能力方面都面臨著挑戰(zhàn)��。
DF的一個獨特之處在于�,任何DENV血清型的初始感染(原發(fā)感染)都可以提供同型和持久的保護,防止單獨使用該血清型的后續(xù)感染�。隨后繼發(fā)感染另一種DENV血清型可導(dǎo)致致命的DSS和DHF。人們普遍認(rèn)為���,異源抗體與DENV結(jié)合���,并通過其Fcγ受體增加單核細胞系細胞的攝取,增加病毒載量并導(dǎo)致嚴(yán)重的登革熱�����。因此,DENV疫苗必須防止所有四種血清型的感染�。登革熱疫苗的開發(fā)是一個復(fù)雜的過程,涉及具有不同衰減特性��、功效和免疫原性特征的各種疫苗原型����。
盡管有效的登革熱疫苗研發(fā)仍面臨各種挑戰(zhàn),但在過去十年中��,登革熱候選疫苗的開發(fā)已取得進展����,其中一些疫苗已在登革熱流行和非流行地區(qū)進入臨床試驗階段。目前��,兩種名為Dengvaxia®和Qdenga®的減毒登革熱活疫苗已被批準(zhǔn)用于登革熱流行地區(qū)的某些人群����。
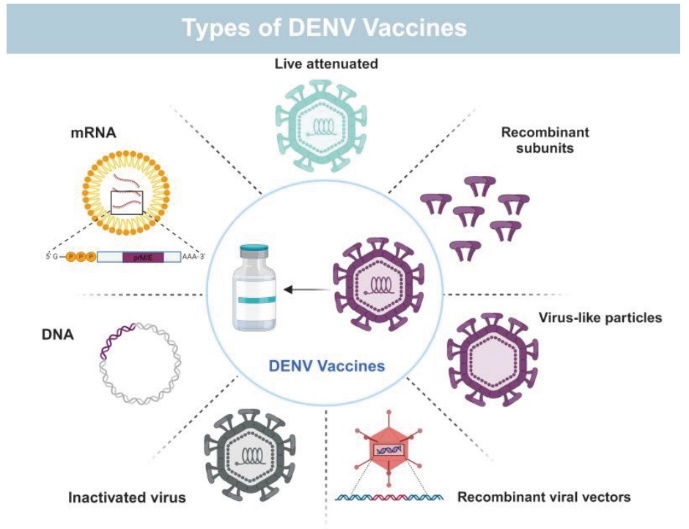
圖4. DENV疫苗種類
(J Microbiol. 2025 Feb;63(2):e2410018. doi: 10.71150/jm.2410018)
AntibodySystem開發(fā)了一系列DENV相關(guān)的高質(zhì)量蛋白、特異性抗體���,助力DENV的基礎(chǔ)研究�。
DENV相關(guān)部分產(chǎn)品目錄
抗體
Anti-DENV-2 E-DII/Envelope Protein E Antibody (2A10)
Anti-Dengue Virus NS1 antibody
InVivoMAb Anti-DENV2 Protein prM/prM Antibody (2H2)
Anti-DENV-2 E-DII/Envelope Protein E Antibody (2A10)
Anti-Dengue and Zika virus EDE1 Antibody (EDE1C10)
Anti-DENV-2 E-DIII antibody (1A1D)
InVivoMAb Anti-DENV-2 Envelope protein E/EDIII (Iv0125)
InVivoMAb Anti-DENV-2 Envelope protein E/EDIII (Iv0124)
重組蛋白
Recombinant DENV-2 NS1/Non-structural protein 1 Protein, N-His
Recombinant DENV-1 Envelope protein E, N-His
Recombinant DENV-4 Envelope protein E, N-His
Recombinant DENV-2 Envelope protein E, N-His
Recombinant DENV-3 Envelope protein E, N-His
Recombinant DENV-2 Envelope protein E, N-His
文獻獎勵

2025年佰樂博生物聯(lián)合AntibodySystem制定了“文獻獎勵”�,若您2025年已發(fā)表引用AntibodySystem產(chǎn)品的文章��,可聯(lián)系佰樂博生物��,我們將予以京東卡或代金券獎勵�。您可以掃描二維碼聯(lián)系產(chǎn)品專員����,或撥打佰樂博生物官網(wǎng)電話進行咨詢,我們將在7個工作日內(nèi)與您聯(lián)系�����。

掃碼添加產(chǎn)品專員微信
咨詢電話:027-65279366
佰樂博官網(wǎng):https://www.biolabreagent.com/
咨詢活性蛋白��,活性抗體�,請訪問:http://invivomab.cn/
http://invivoplus.com/
參考文獻
1. Khetarpal N, Khanna I. Dengue Fever: Causes, Complications, and Vaccine Strategies. Journal of Immunology Research. 2016;2016:1-14. doi:https://doi.org/10.1155/2016/6803098
2. Parveen S, Riaz Z, Saeed S, et al. Dengue Hemorrhagic Fever: A Growing Global Menace. Journal of Water and Health. 2023;21(11). doi:https://doi.org/10.2166/wh.2023.114
3. Yan K, Mao L, Lan J, Xiao Z. Advancements in dengue vaccines: A historical overview and pro-spects for following next-generation candidates. Journal of Microbiology. 2025;63(2):e2410018. doi:https://doi.org/10.71150/jm.2410018
4. Khan MB, Yang ZS, Lin CC, et al. Dengue Overview: An Updated Systemic Review. Journal of Infection and Public Health. 2023;16(10). doi:https://doi.org/10.1016/j.jiph.2023.08.001